作者 | 程永顺 吴莉娟 北京务实知识产权发展中心
引言:2020年6月28日,第十三届全国人大常委会第二十次会议对《中华人民共和国专利法修正案(草案二次审议稿)》(简称“二次审议稿”)进行了审议,并于2020年7月3日向社会公开征求意见。
二次审议稿第七十五条增加的三个条款:
“专利权人或者利害关系人认为申请上市药品的相关技术方案落入中国上市药品专利信息登记平台登载的相关专利权保护范围的,可以自国务院药品监督管理部门公示药品上市许可申请之日起三十日内向人民法院提起诉讼或者向国务院专利行政部门申请行政裁决。专利权人或者利害关系人逾期未提起诉讼或者请求行政裁决的,药品上市许可申请人可以请求人民法院或者国务院专利行政部门确认申请上市药品的相关技术方案不落入中国上市药品专利信息登记平台登载的相关专利权保护范围。”
“人民法院或者国务院专利行政部门自专利权人或者利害关系人请求受理之日起九个月内作出生效裁判或者行政裁决的,对技术审评通过的化学药品上市许可申请,国务院药品监督管理部门可以根据人民法院裁判或者国务院专利行政部门行政裁决,作出是否批准药品上市的决定。当事人对国务院专利行政部门行政裁决不服的,可以自收到行政裁决之日起十五日内向人民法院起诉。”
“国务院药品监督管理部门会同国务院专利行政部门制定药品上市许可审批与药品上市许可申请阶段专利纠纷解决的具体衔接办法,报国务院同意后实施。”
这既是为了落实有关经贸协议而增加的关于药品专利纠纷早期解决机制(一般也被称为“药品专利链接制度”)的相关规定,实际上也是《专利法》第四次修改全面落实2017年10月8日中共中央办公厅、国务院办公厅发布的《关于深化审评审批制度改革
鼓励药品医疗器械创新的意见》(简称“两办《意见》”)这一份鼓励医药产业创新的纲领性文件相关规定的体现。
就其中的规定而言,似乎与韩国的药品专利链接制度中的一些元素存在着相似之处,但鉴于两国的国情和制度存在差异,直接将这些制度引入到我国专利法,特别是药品专利链接之一新的制度中是否合适,值得进一步考量。
2006年起,全球药物市场从美日欧转向中国、巴西、俄罗斯和韩国等新兴市场转变。韩国2014年发布的《药业2020前景》指出,2020年前,将投入89亿美元用于药品研发,扶持更多国内制药公司进入世界市场,韩国药品市场规模也有望在2020年达到243亿美元。[1]
2015年,韩国药品市场规模已占全球药物市场份额的1.5%,位列全球药品市场第14位。据韩国食品药品安全部(MFDS)和韩国制药商协会数据,截至2015年,韩国约有894家制药工厂,生产药品品种近2.7万种,产值近160亿美元;393家医药部外品生产厂家,生产产品7200多种,产值约12.4亿美元;1895家化妆品生产商,生产品种近9万种,产值约63.8亿美元;2607家医疗器械生产厂,生产品种1万多种,产值约34亿美元。除本土企业外,韩国市场目前还活跃着近50家跨国企业或合资企业,占据韩国处方药市场近60%的份额,包括赛诺菲、默克、辉瑞、诺华、葛兰素史克、礼来和阿斯利康等。[2]
韩国和美国于2010年签订了自由贸易协定,该协定于2012年3月15日生效。该协定中包含了关于药品专利保护期补偿、药品专利链接制度、药品数据保护制度等相关规定。协定生效后,韩国开始着手建立“专利清单”,并实施仿制药专利声明制度,直至2015年3月15日才开始全面实施专利链接制度。

图1:韩国专利链接制度[3]
韩国药品专利链接制度在框架上与美国的专利链接制度类似,但在一些具体规定上则存在不同,制度设计更切合韩国自身的国情和制度现状,尤其体现为考虑到国内原研药企业仅占15%的产业状况[4],韩国专利链接制度为仿制药产业提供更有力的保护,这是由于韩国医药产业主要是由仿制药产业构成,而韩国国家医疗体系有赖于仿制药的稳定供应所造成的。[5] 韩国制度和美国的差异主要表现为以下三个方面:第一,较之于美国的原研药企,韩国原研药企进行专利登记的难度更大。为避免纳入不直接相关的专利,导致仿制药上市的不当延迟,韩国建立了专利登记审查制度。MFDS负责对登记专是否符合要求,尤其是相关性进行审查。而美国FDA则几乎不干预专利信息登记的相关事宜。仿制药企有权请求MFDS修改或删除不当登记的专利。第二,韩国仿制药企有权通过行政审理获得关于是否落入专利权保护范围、专利权无效等的裁决,而无需提起耗时费力的诉讼。而原研药企业要获得九个月的遏制期还需另行提交申请,但在美国,三十个月的遏制期是专利挑战提起后,原研药企可以自动获得的。第三,韩国首仿药的范围比美国大,在首个仿制药企发出通知后的14日内发出通知的仿制药企,均可以视为首仿药。一旦挑战成功,则可以共享九个月的市场独占期。对于没有正当理由延迟上市的首仿药,MFDS有权撤销其市场独占期,这也使得反向支付对韩国原研药企较之于美国的仿制药企,缺乏吸引力。[6]
与美国专利链接制度一样,韩国的专利链接制度也是建立在专利信息公示的基础上。根据《韩国药事法》第50-2条之规定,原研药企业应在获得上市批准30日内(如专利在药品获批上市后核准,则在专利授权后30日内)将向食品药品安全部(MFDS)申请将获批药品的专利信息登记在《药品专利清单》中。这份清单也称为“绿色清单”。根据规定,“绿色清单”中所登载的专利应为与批准上市的药品或其用药方法直接相关的化合物、剂型、组合物及用途专利。所登载的专利应为获得上市审批前已经提交申请,且尚未过期的专利。而药品获批上市后申请的专利则不能列入“绿色清单”。专利权人可以申请删除或修改登记的专利信息,MFDS也有权依职权删除或修改登记的专利信息。
韩国自2012年3月15日开始实施“绿色清单制度”,至2015年3月药品专利链接制度全面实施前完成了相关药品专利信息的登载与公示。相较于美国的“桔皮书”,韩国的“绿色清单制度”为促进仿制药的竞争做了修订,主要表现为:第一,可登载于“绿色清单”的专利的范围比“桔皮书”小,如风险评估与减轻策略(REMS)相关专利,可以纳入桔皮书中,但不能纳入绿色清单中;绿色清单中登载的专利仅限于药品获批前提交申请的专利;新药申请人应逐条登记权利要求,而桔皮书并无此要求。第二,MFDS负责管理绿色清单,而FDA拒绝管理桔皮书。较之于FDA对于桔皮书相对粗放的态度,MDFS在绿色清单的建立和管理过程中发挥着积极主动的作用,包括对登载专利的适格性进行实质审查,尤其是对“直接相关性”作出狭义解读,往往要求专利权利要求与获批药品精确对应,MFDS有权对登载的权利要求进行修正以缩小其权利要求的保护范围,进而其得以与获批药品直接对应。MFDS还有权依职权对不在符合要求的登载专利信息进行修改或删除。在此之前,MFDS应听取包括仿制药申请人在内的利害关系人的意见。[7]
根据《韩国药事法》第50-4条之规定,仿制药申请人提交上市申请时,应向登载专利的权利人或将该专利登载在“绿色清单”中的原研药企业(以下合称“专利权人”)发出载有提交上市申请的事实、提交申请的时间等规定事项的通知。但下述情形不适用通知制度:1. 登记专利的保护期限届满(类似于美国ANDA第II段声明);
2. 申请人拟于登记专利保护期届满后上市销售仿制药(类似于美国ANDA第III段声明);
3. 专利权人明示同意仿制药申请人无需提交通知(即获得授权的仿制药)。
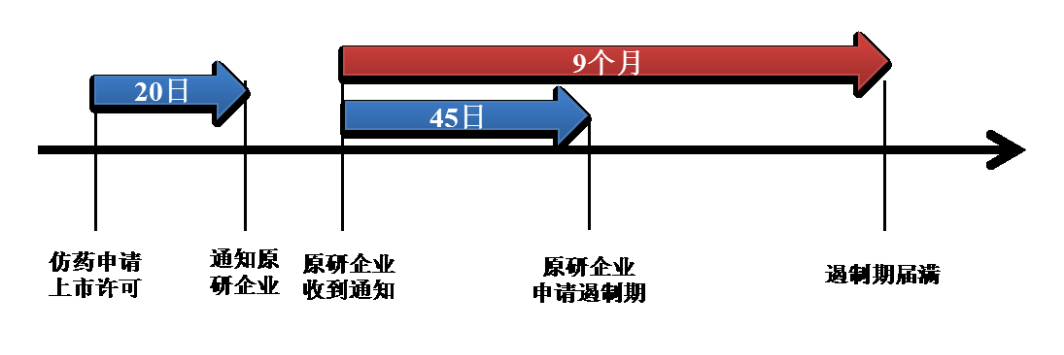
前述通知应自仿制药上市申请提交之日起20日内发出。若未能在前述期限发出通知,则MFDS将以仿制药申请人向登载专利的权利人或将该专利登载在“绿色清单”中的原研药企业发出通知之日(以较晚发生者为准),作为仿制药申请的提交日。若仿制药申请人始终未发出通知,则其仿制药上市申请将不予批准。
根据《韩国药事法》第50-5条之规定,专利权人在收到仿制药申请人的通知之日起45日内,专利权人或原研药企应向MFDS提交制止仿制药上市的申请。MFDS认为申请符合法定条件的,则应给予9个月的遏制期,自专利权人收到仿制药申请人的通知之日起计算。对于同一个仿制药,遏制期仅适用一次。与美国专利链接制度的遏制期相比,韩国的遏制期存在如下不同:第一,韩国的遏制期仅为9个月,而美国则为30个月。根据韩国知识产权局2014年的数据,在专利侵权诉讼案中从受理到做出有效一审判决的平均时间为7.9个月。因此9个月的遏制期可以反映在韩国专利侵权诉讼案中从受理到判决最长的平均时间, 符合韩国司法实践和国情。第二,韩国的遏制期需要由专利权人向MFDS提出申请,并进行审查后认为符合法定条件后方能获得,而美国的遏制期则是在专利权人提起诉讼后即自动获得。第三,遏制期内,仿制药仅仅是不能上市销售,但并不影响仿制药的技术审评以及获得上市许可。美国的遏制期内,FDA依旧会进行技术审评,但不会发放上市许可。第四,发生法定情形,MFDS有权撤销或取消遏制期,但美国制度中并没有相关规定。专利权人要获得遏制期,应在提交申请前,(1)依据《韩国专利法》第126条之规定向法院提起侵权或预防专利侵权之诉,或(2)依据《韩国专利法》第135条之规定向,韩国知识产权局(KIPO)的知识产权审判与上诉委员会(IPTAB)提起积极的确认专利权范围的请求(即请求确认仿制药技术方案落入其专利权保护范围)之请求。若仿制药申请人已经向IPTAB提起消极的确认专利权范围的请求(即请求确认仿制药技术方案没有落入登载专利的权利保护范围),则专利权人应予应对,且无需再提起确认请求。专利权人提交遏制期申请时,应声明:(1)该请求系基于合法登载在绿色清单的专利权作出;(2)提起的侵权诉讼或专利权权人请求符合诚实信用原则,有胜诉的可能,且不会不合理地拖延相关程序。[9]根据《韩国药事法》第50-6条第(1)款之规定,在以下情形下,MFDS将不予批准遏制期的申请:(1)遏制期申请提交超过法定期限的;(2)相关专利已到期、放弃或终止的;(3)专利权人未提起诉讼或确认请求的;(4)以欺骗手段登载专利的;(5)存在两种或两种以上具有相同的主要成分及含量、剂型、用途、效力的仿制药,专利权人仅针对其中部分仿制药提交遏制期申请的;(6)已基于该参比药物的安全性和有效性信息批准了相同的仿制药上市的;(7)已作出仿制药未落入专利权保护范围、登载专利无效或专利登记不合法的行政决定或司法判决的;(8)专利被征用或属于政府发明的。[10]根据第50-6条第(3)款之规定,在9个月遏制期内,有关决定或判决认定专利权无效、仿制药不侵犯专利权、仿制药技术方案未落入保护范围、专利登记不合法,专利权人撤回其侵权诉讼或确认专利权范围请求或者被驳回,当事人达成调解或和解协议或仲裁机关作出决定,原研药批件到期,专利保护期届满,或者公平贸易委员会或法院认定专利权人违反反垄断法相关规定的,遏制期终止(以先发生之日为准)。[11]
与美国制度类似,为鼓励仿制药进行专利挑战,促进药品市场竞争,推动仿制药尽快上市,韩国专利链接制度对首个提起仿制药上市申请并获得专利挑战成功的仿制药申请人授予9个月的市场独占期(除非行政决定或判决走出时间超过9个月)。规定9个月主要是适应韩国医院药品招标采购的年度计划,利于首仿药企业的市场开拓,并补偿仿制药企在专利诉讼中所耗费的资金。在该市场独占期内,其他仿制药企业不得上市销售与原研药具有相同活性成分,并且与首仿药物具有相同含量、剂型和药效的仿制药。该市场独占期自首仿药可以上市之日起计算。如果涉及纳入医保体系,则该市场独占期还可以进一步延长至多两个月(即共计11个月)。与美国仅有提起ANDA的仿制药才能作为首仿药不同,韩国的首仿药的适用范围更广,其面向的是所有提交上市申请的仿制药。不仅同日提交上市申请的仿制药可以共享独占期,在第一个请求人提出请求之后14日内提出相应请求的,或最早获得宣告专利无效或专利保护期延长无效或被认定不落入专利权保护范围或不侵权的等有利决定的(即专利挑战成功的),都被视为首仿药。仿制药要获得市场独占期,同样需要向MFDS提交相关申请,并且在提交申请前,依据《专利法》向IPTAB提交相关请求,包括:(1)《专利法》第
133 条规定的专利无效审判;(2)《专利法》第 134 条规定的专利保护期延长无效审判;(3)《专利法》第 135
条规定的消极的确认权利范围的审判。[12]此外,韩国于2017年3月1日实施了新的专利异议制度(《韩国专利法》第132-2条)。根据相关规定,针对2017年3月1日之后授权的专利,任何人可以专利授权后6个月内向IPTAB提起撤销专利的请求,请求人(挑战者)应提交详细的异议事由及证据,异议事由仅限于新颖性、创造性、重复授权及抵触申请。提起专利异议所依据的现有技术并不限于专利审查授权时所引用的现有技术。异议程序是IPTAB与专利权人之间的单边程序,异议请求人并不会参与到程序中,而专利权的利害关系人可以参与到程序中为专利权人提供帮助。IPTAB认为异议成立,专利应被撤销的,应事先将撤销理由通知专利权人,专利权人可以提交书面意见对权利要求或说明书进行修改,但修改仅限于:限缩权利要求的保护范围,更正笔误及澄清不清楚的表述,该修改不得扩大或改变权利要求的保护范围。若IPTAB认为异议不成立的,则会驳回异议,专利将维持有效,且异议请求人无权请求司法复审;若专利被撤销,专利权人可以进一步上诉到专利法院请求司法复审。[13](1)无效程序解决的是专利权人及第三人之间的争议,只有利害关系人和审查员才能启动无效审判。利害关系人介入该程序既可以帮助专利权人,也可以帮助挑战者。(2)专利无效程序可以在专利授权后任何时间内提出,即使是专利到期后依旧可以提出。在作出最终裁决前,无效诉讼可以随时撤回,但撤回无效诉讼需获得已经提交答辩的专利权人的书面同意。(3)无效请求的法定事由范围比异议更宽泛,除了与专利异议程序相同的新颖性、创造性、重复授权及抵触申请等事由外,还包括说明书不清楚,无法得到支持,无法实施,违反联合申请约定私自提交申请,专利发明的公开实施等。(4)无效程序是无效请求人与专利权人之间的双边程序,IPTAB则对其中涉及的事实和技术问题进行听审。专利无效程序一般需要10-18个月,如果请求加速审理,则可以在4-6个月内审结。败诉方(无论是专利权人还是挑战者)均可以在收到决定由30日内向专利法院申请司法复审。[14]因此,尽管专利异议程序并非是《韩国药事法》明确规定的仿制药申请人获得首仿药独占期应提交的请求,这可能是受限于提起专利撤销的法定期限限制,但理论上,若登载专利是在药品获批上市后授权的,仿制药申请人仍可以通过该程序撤销专利或促使专利权人缩小专利权的保护范围,进而在专利挑战中获得有利的裁决结果。为防止首仿药滥用市场独占制度,《韩国药事法》第50-10条规定了首仿药市场独占期终止的情形,包括:(1)仿制药批件到期、失效或登载专利被无效(不包括首仿药专利挑战导致的无效);(2)仿制药的有利决定或判决被撤销或改判;(3)仿制药自可上市之日起两个月内仍未上市;(4)公平贸易委员会或法院认为首仿药申请人的行为违反反垄断法的相关规定;(5)首仿药申请人以欺骗手段获得市场独占期。药品专利链接制度引入以来,韩国几乎没有再出现过上市后的侵权纠纷。据统计,截止2018年3月,在全面实施专利链接制度3年间,原研药企业和仿制药企业共向IPTAB提交涉及专利链接的请求2928件。2015年,共有无效宣告请求1801件,消极的权利范围确认请求410件;到2017年,无效宣告请求只有22件,而消极的权利范围确认请求共372件。3年间,知识产权审判与上诉委员会共审结2248件涉及专利链接的请求。在仿制药企业进行的专利挑战中,无效宣告请求胜诉的有265件(成功率24%),消极的权利范围确认请求胜诉的有465件(成功率74%)。从前述数据可以看出,就专利挑战请求的类型而言,除了制度实施之初,正常情况下消极的权利范围确认请求的案件量明显高于无效宣告请求的案件量,其原因在于消极的权利范围确认请求容易被认可,而且该结果仅对特定仿制药企业的特定仿制药有效,其他仿制药企业难以直接利用这一结果。而无效请求如果仿制药企业胜诉,则其他任何相关仿制药企业也都能“搭便车”上市其仿制药。因此,仿制药企业更倾向于选择通过消极的权利范围确认请求来挑战原研药专利。在消极的权利范围确认请求中,作为请求人的仿制药企业需要公开其实施的技术内容或制备方法,但很多时候争论的焦点在于其公开的技术内容或制备方法是否确实与仿制药报批申请的内容一致。而消极的权利范围确认请求成功率高的原因之一在于,请求人公开的技术内容并不触及专利权的内容。专利权保护范围确认请求制度是一项颇具韩国特色的制度,该制度规定于《韩国专利法》第135条。该制度并非为药品专利链接而专门设定的制度,而是韩国专利法中的原本就有的制度和规则。这一制度的设计目的旨在事先预防侵权。其仅是对是否落入专利权保护范围的确认,是认定侵权与否的其中一个要素,但并不等同于侵权认定。其确认结果与是否构成侵权并没有直接对应关系。
韩国司法实行的是三级三审制。目前,与知识产权相关的案件审判涉及的三级分别为韩国知识产权审判与上诉委员会(IPTAB)、韩国专利法院和大法院(韩国最高法院)。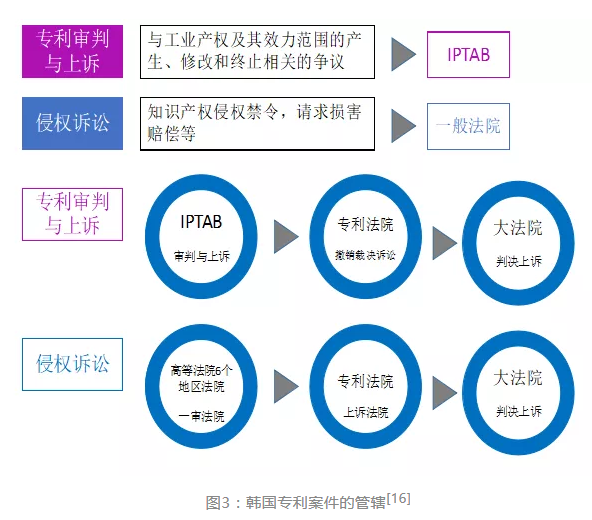
IPTAB是在合并了原审判委员会和上诉委员会的基础上成立的,于1998年3月1日起开始运作。它是韩国知识产权局中的准司法机构,作为知识产权相关案件的第一审级在KIPO中完全独立运作(类似但不完全等同于中国2018年3月机构改革之前的专利复审委员会在国家知识产权局中的位置)。IPTAB包括11个审判委员会(第1、2、3审判委员会负责商标案件,第4、5审判委员会负责机械专利案件,第6、7委员会负责化学专利案件,第8、9委员会负责电子通信专利案件,第10委员会负责复杂技术专利案件,第11委员会负责商标及外观设计案件),以及审判政策部和诉讼部。每个审判委员会包括约10名负责案件听审的专利行政法官(目前共有96名法官)[17],一般来说,这些法官都是在KIPO工作了10年以上的高级审查人员;审判政策部负责接收文件,进行形式审查,审判质量评估,口审等;诉讼部负责处理知识产权局局长作为被告的案件。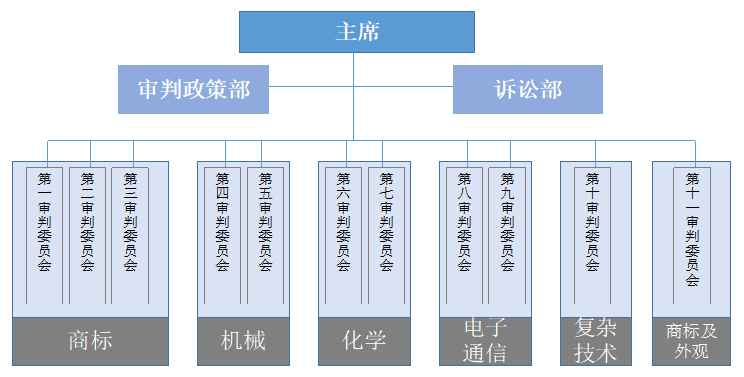
IPTAB审理的专利案件包括单边程序案件(如专利驳回,专利修改),双边程序案件(如专利无效,专利保护期延长无效,专利权利范围的确认,专利修改无效,授予非独占许可等)以及专利异议案件。
在韩国,确认权利范围的请求(以下简称“确认之诉”)是与侵权之诉、专利无效诉讼均相对独立的程序。侵权之诉依据的是《韩国专利法》第126条,专利无效依据的是《韩国专利法》第133条,而确认之诉依据的是《韩国专利法》第135条。
1.确认之诉及其争议
《韩国专利法》第135条规定:(1)专利权人及独占被许可人为了确认获得专利的发明的保护范围,可以请求确认专利权的权利范围(即积极的权利范围确认请求);(2)利害关系人为了确认他人获得专利的发明的保护范围,可以请求确认专利权的权利范围(即消极的权利范围确认请求);(3)在提交第(1)项和第(2)项请求时,若有多个权利要求,可以对每个权利要求分别提出请求。如前所述,确认之诉的目的旨在实现预防侵权,相对于侵权诉讼,其诉讼成本低,审理速度快,但其与侵权判定之间没有必然的因果关系,也不会引发侵权程序所导致的法律后果,如停止侵害,损害赔偿等。一般而言,在侵权诉讼中,即使认定被控侵权产品落入专利权的保护范围,被控侵权人依旧可以通过主张专利权无效、现有技术抗辩、先用权抗辩等事由,最终并不会被认定为构成侵权,更无须承担侵权责任;而如果被控侵权产品被认定为没有落入专利权的保护范围,则一般不会构成侵权。可见,即使对是否落入权利保护范围进行了确认,在侵权诉讼中,依旧可能得出不一样的结论,由此还会引发双重诉讼问题。对于IPTAB作出的确认之诉的裁决,双方均可以上诉到专利法院申请司法复审,并再进一步上诉到韩国大法院(即韩国最高法院)进行终审。与专利无效案件一样,专利法院对确认之诉进行的司法复审程序同样是专利权人和涉嫌侵权人之间的争议。IPTAB并不会成为被告。实践中,双方当事人通常会在二审程序中达成调解或和解。有鉴于此,确认之诉是否还有存在的必要在韩国也曾引发过讨论。有人提出这个程序并没有太多存在的价值,可将其并入到其他程序中。但韩国大法院认为,该程序依旧有存在的价值,并通过更改侵权案件二审的管辖权,将侵权诉讼的二审由原来的一般高等法院集中到专利法院统一管辖,而专利法院也是确认之诉的二审法院,在一定程度上减少了(但不可能完全消除)两种程序结果不一致的情形。根据相关规定,确认之诉与专利无效的第一审均由IPTAB管辖。仿制药等可能涉嫌侵犯专利权的主体通常会提起消极的确认之诉和/或请求专利无效审判。两类案件的审理程序并没有太大的区别。如果两个程序同时进行,IPTAB一般会将两个程序进行合并审理。当然,实践中,也有为数不多的案件中,两个程序并没有合并审理。根据韩国专利法的相关规定,专利无效宣告只能由专利无效审判作出。在消极的确认之诉中,专利无效不作为确认是否落入权利范围的抗辩事由,而只能主张现有技术抗辩。即使请求人将专利无效作为请求确认不落入专利权保护范围的理由,IPTAB通常也不会予以考虑。如果仅仅有确认复审程序,而IPTAB在审理过程中发现相关专利有无效的事由,IPTAB也不会因此而宣告专利权无效,但IPTAB会以相关专利为自由实施技术为由,裁定提起消极的确认之诉的请求人的相关技术没有落入专利权的保护范围。专利权人可以通过向IPTAB提起积极的确认之诉确认涉嫌侵权人的技术方案落入其专利权的保护范围,也可以通过向地区法院提起专利侵权诉讼,请求禁令和损害赔偿。如前所述,确认之诉并不会产生任何禁令或损害赔偿的法律后果,事实上,多数情况下,专利权人倾向于选择专利侵权诉讼以寻求救济,这从药品专利链接纠纷中,专利权人提起的诉讼类型的分布可见一斑。而考虑到积极的确认之诉由具有技术背景的IPTAB进行第一审,且审理速度更快,成本更低,专利权人往往将积极的确认之诉作为专利侵权诉讼的辅助程序提出。在专利侵权纠纷案件二审管辖权改变之后,积极的确认之诉和专利侵权诉讼的二审都会集中到专利法院。如果两个程序可以同时进行,法院通常会合并审理,并在审理中考虑积极的确认之诉的结果,进而对专利侵权纠纷作出认定。如果两个程序未能同时上诉到专利法院,则专利法院的在后裁决,会依据在先裁决作出。实践中,包括在专利链接制度中,专利权人倾向于提起专利侵权纠纷(在专利链接制度中,这是上市药品专利权人获得遏制期的法定要件之一),而仿制药等涉嫌侵权人(也被称为实施者)倾向于提起消极的确认之诉(在专利链接制度中,这是仿制药获得市场独占期的法定要件之一)。由于在消极的确认之诉中,实施者提交的并非是涉嫌侵权的产品,而是对于相关产品的文字描述,一旦该文字描述与实际产品并不一致,可能会出现涉嫌侵权人在消极的确认之诉中获得了有利的裁决(即IPTAB认定涉嫌侵权的技术方案没有落入专利权的保护范围),但是在侵权案件中,依旧被认定为侵权,而需要承担停止侵权、损害赔偿等法律责任。双重诉讼且结果可能会产生矛盾,这也是确认之诉备受诟病的重要原因。考虑到涉嫌侵权人提起消极的确认之诉和应对专利权人的侵权诉讼需要承担双重的诉讼成本,同时在侵权纠纷中败诉,还要承担损害赔偿等法律责任,并考虑到事实上很难证明涉嫌侵权人故意在消极的确认之诉中提交与实际产品不一致的技术方案的文字描述,因此,即使出现这种情况,法院也不会因侵权人的故意侵权,而加重其应承担的法律责任。但是在专利链接纠纷案件中,则可能会出现这样的情形:仿制药提起消极的确认之诉并获得了对其有利的裁决,MFDS基于此批准仿制药上市,且仿制药可能还会获得9个月的市场独占期;而后,法院裁决仿制药构成对上市药品专利权的侵害。由于韩国专利链接制度实施的时间并不长,似乎目前还没有出现该情形。有韩国实务届人士认为,这种情形下,考虑到社会福利,可能并不会禁止仿制药的上市销售,但可能会要求仿制药对专利权人的损失予以赔偿,这个赔偿可能是仿制药上市后导致原研药价格下跌的损失,但这是否可以认为是某种形式的强制许可或者类似于标准必要专利的许可值得进一步探讨。也有人认为,这种情况下,双方很有可能会自行达成和解或许可。至于实践中如果出现了前述情形会如何处理,还有待实践的进一步考察和验证。二次审议稿第七十五条中,至少有两个元素似乎是借鉴了韩国专利链接制度的相关规定:其一是引入了确认之诉(包括积极的确认之诉和消极的确认之诉);其二是将遏制期规定为九个月。但这些规定是否与中国的国情相适应值得商榷。首先,就市场体量而言,中国似乎与美国更为相似。中国的药企数量是韩国的数倍,尽管也是仿制药占主导地位,但产业现状和发展趋势与韩国仍存在差距。推动医药产业创新发展是中央政策的重点。实现药品的可及性,需要创新药产业和仿制药产业的平横发展。没有创新,就没有仿制。要解决十四亿人口的健康问题,实现“全民健康,全民小康”,需要创仿平衡,这也是美国专利链接制度备受肯定和推崇的原因。第二,韩国专利链接制度中采用的确认之诉并非新设程序,而是援引韩国专利法中既有的普遍适用于各类专利的行政程序,并未新增行政成本和人员组成。而在二次审议稿第七十五条引入的确认之诉,则是在中国引入了新的程序。第七十五条第二款实际上引入了两种新的诉由,请求确认落入专利权保护范围(类似于韩国的积极的确认之诉)和请求确认不落入专利权保护范围(类似于韩国的消极的确认之诉),这两种诉由在目前的司法实践中,因为被认为缺乏诉的利益,而不被允许作为独立的诉讼请求。中国的制度和实践与韩国存在差异,根据中国目前的司法实践,涉及专利权侵权认定和专利权效力确定的诉由包括三种,即,侵犯专利权之诉、专利无效之诉以及请求确认不侵权之诉。这三类诉讼有明确的诉的利益、起诉条件以及诉讼后果,三类诉讼之间的界限是明确的。而新引入的确认之诉与侵犯专利权、专利权无效和请求确认不侵权之间是什么关系,与这三类诉讼之间的界限是什么,如何与其他诉讼程序相衔接,值得商榷。第三,目前国务院专利行政部门(即国家知识产权局)负责专利授权、无效。新引入的确认程序,其实质上属于专利侵权判断的一部分,与人民法院现有职能重复,与目前的既有职能较为疏离,势必要新增扩充专业人员,从而增加了行政成本。按照目前的制度设计,国务院专利行政部门对确认之诉作出的裁决属于行政裁决,其生效仍然需要人民法院进行裁判。目前我国法院并没有对专利权效力进行认定的权利,在专利无效行政程序中也没有司法变更权,这与包括韩国在内其他国家和地区的实践并不相同,因此,其结果将可能会与目前的专利无效行政诉讼一样,导致循环诉讼,造成资源的浪费和当事人的诉累。此外,由于在行政裁决的后续行政诉讼,国务院专利行政部门从行政程序中的居中裁判者转变为代位被告,极有可能成为一方当事人的强势代理人,并对另一方当事人的利益造成损害。这与韩国的IPTAB作为KIPO中的独立运作的准司法机构,并不作为被告参与确认之诉的司法复审有着本质区别。而由于是行政诉讼,双方当事人有并非原被告双方,难以达成和解、调解。第四,韩国IPTAB的案件审理基本上能在九个月内审结,而就目前第七十五条的规定而言,如果为了给原研药和仿制药上市提供商业确定性,将其侵权纠纷提前到仿制药上市之前予以解决,法律上提供了司法和行政两种救济途径,那么,这两种途径都应该有利于实现制度设计的目的,也就是提前解决纠纷,明确药品上市之后的商业确定性和可预见性。但是,就目前来看,司法途径要求的是生效的司法判决,根据程序法的相关规定,理论上是要经过两审的判决。按照目前法院长年的司法实践,似乎很难九个月之内作出生效判决。而行政裁决是否也应该是生效的行政裁决却并不明确。从法条行文上看,似乎并不要求是生效的行政裁决。目前的二次审议稿规定的是,药监部门根据行政裁决作出是否批准仿制药上市的决定,而后,行政裁决的当事人如果对行政裁决不服,可以向法院提起行政诉讼。也就是说,药监部门似乎可以先行根据行政裁决作出是否批准仿制药上市的决定,而后再进行行政裁决的司法复审,这似乎与韩国的相关规定类似,由此引发的另一个可能的忧虑是,原研药或者仿制药是否会因为行政途径裁决迅速而多倾向于诉诸行政途径,进而导致司法途径对此类案件的管辖权实际上被排除?而行政途径解决此类纠纷的结果将引发的一系列后续的问题是否会导致整个制度设计偏离原来的初衷和轨道,而进入一个更为混乱,不具有确定性,纠纷处理更为复杂,当事人诉累更重的境地?韩国的专利链接制度在制度设计是基本以美国的制度作为模板,并结合自身的医药产业发展水平以及本国法律制度的特点,而进行了很多本土化的设计。制度整体上倾向于对仿制药产业的保护,这是由于韩国国内仿制药产业占绝对比重所决定的。同时,与美国的市场化不同,韩国更关注药品的可及性问题。尽管中国医药产业中仿制药也是主导,药品的可及性也是需要关注的问题,但中国的市场体量、司法制度和行政体系与韩国有着很大的不同。加之韩国的专利链接制度自2016年3月全面实施以来仅仅经过了四年多的时间,与美国近四十年的实践发展相比,可谓短暂。韩国的相关制度可有实现专利纠纷的早期、有效解决,尚待实践和时间的进一步观察和检验。中国引入了韩国制度的部分元素,一方面,这些元素在韩国制度中之所以能够正常运作是由于这些元素是与韩国的整体制度框架想匹配的,仅仅因素其中几个元素,难免会有失偏颇,乃至挂一漏万;另一方面,这些元素是否能适应中国的国情,是否能实现制度设计的目的,乃至是否能达到韩国制度的效果,都是值得进一步深入研究的。
注释:
[1]郭晓丹:《韩国医药市场全解》,载《进出口经理人》,2017年第1期。
[2]同前注。
[3]金杜律师事务所:《金杜知识产权保护蓝皮书:各国专利链接制度比较研究以及在我国建立专利链接制度探讨》,第26页。
[4]http://www.beagle-hc.com/Dantai_seiyakukaisha/Seiyakukaisha.html#korea.
[5]Ki
Young Kim et al., The Korean Pharmaceutical Approval-Patent Linkage
System: A Comparison with the US Hatch-Waxman Act, LEXOLOGY 1, 15 (Feb.
16, 2015), https://www.lexology.com/library/detail.aspx?g=
5619213a-4714-4307-8bfd-8e12955841e1.
[6]Kimberlee
Thompson Raley:The South Korean Patent Linkage System: A Model for
Reforming the United States Hatch-Waxman Act, Emory International
Review, Vol. 33 (2019), pp 468-469.
[7]同前注,第474-476页。
[8]同前注3,第26页。
[9]邱福恩:《韩国药品专利链接制度介绍及对我国制度的启示》,载《电子知识产权》,2019年第3期。
[10]同前注。
[11]同前注。
[12]同前注6,第480页。
[13]New
Patent Cancellation System for South-Korea,
https://www.lcpatents.eu/en/news/new_patent_cancellation_system_for_south-korea/21.
[14]同前注。
[15]同前注3,第34-35页。
[16]IPTAB, https://www.kipo.go.kr/upload/en/download/brochure_IPTAB.pdf.
[17]同前注。
[18]同前注。