2020 年诺贝尔化学奖花落基因编辑技术!“基因剪刀”专利如何重写生命密码?
众望所归的CRISPR/Cas9基因编辑技术获得了今年的诺贝尔化学奖。10月7日,瑞典皇家科学院授予法国科学家埃曼纽尔·卡彭蒂耶(Emmanuelle Charpentier)和美国科学家詹妮弗·杜德纳(Jennifer A.Doudna)诺贝尔化学奖,以表彰她们在基因编辑技术方面的贡献。这一技术被称为“基因剪刀”技术。研究人员利用这项技术可以极其精确地改变动物、植物和微生物的DNA。“它不仅彻底改变了基础科学,可以创造新型作物,还开创了新的医疗方法。”诺贝尔化学奖委员会主席克拉斯·古斯塔夫松表示。
和以往的基因编辑技术相比,“基因剪刀”技术简单、易学、价廉,大大降低了重写生命密码的门槛,能广泛应用到农业、医疗、工业、环境等领域。2012年8月,卡彭蒂耶和杜德纳成功解析CRISPR/Cas9基因编辑的工作原理后,其应用就得到快速推进。2013年2月,美籍华裔科学家张锋首次将CRISPR/Cas9基因编辑技术应用于哺乳动物和人类细胞。双方一度合作成立公司,共同推进CRISPR/Cas9基因编辑技术在疾病治疗方面的研发。值得一提的是,张锋此次虽未能摘得诺贝尔奖,但在CRISPR/Cas9技术研发与应用方面同样居功至伟。
后来,卡彭蒂耶、杜德纳与张锋因专利权属发生争议,不过,各方通过布局专利推广CRISPR/Cas9应用的步伐从未停止。目前,全球关于CRISPR/Cas9的应用呈爆炸式增长,我国在CRISPR/Cas9应用方面走在了前列。植物研究人员利用该技术开发了抗霉菌、害虫和干旱的作物,新的癌症疗法正在进行临床试验,治愈遗传性疾病的梦想或许在不远的将来就能实现。
“基因剪刀”有何魔力?目前这项技术的专利布局情况怎样?应用重点有哪些领域?对此,本报记者采访了代理过多件CRISPR/Cas9相关专利申请的北京康信知识产权代理有限责任公司专利代理师沈敬亭、陈知宇、曲在丹。
问:什么是CRISPR基因编辑技术?为什么会被称为“基因剪刀”技术?
答:CRISPR是英文clustered, regularly interspaced, short palindromic repeats的缩写,即规律成簇间隔短回文重复。它是从细菌和古菌进化出来抵御病毒和质粒入侵的RNA指导的适应性免疫系统,其中含有曾经攻击过该细菌的病毒的基因片段。它利用RNA来引导核酸酶与特定核酸序列相结合并且将它们切断。当病毒入侵细菌时,细菌能够捕捉到外来遗传物质的片段并且将它们整合到自身基因组中的CRISPR序列中。CRISPR序列转录生成的CRISPR RNA(crRNA)能够与Cas核酸酶相结合,通过与靶点核酸序列进行碱基配对为Cas核酸酶提供结合特异性。Cas核酸酶和crRNA结合之后,能够在细菌体内起到监控病毒入侵的作用,当与crRNA匹配的遗传片段再度出现时,Cas核酸酶能够切断这些遗传片段,从而提供免疫保护作用。
借用一篇科普文献的思路,我们可以将细菌的防御系统想象成一个资料库(CRISPR序列)+一个剪刀工厂(Cas),细菌处理外来遗传物质的片段并且将它们整合到自身基因组中的CRISPR序列中,而其中的重复片段则充当分隔这些病毒信息的挡板。剪刀工厂生产不同的Cas蛋白。
每当有新病毒进攻,剪刀就会跑出来剪断它的DNA,然后把其中一小段带回资料库里储存起来,这段DNA会转录成CRISPR RNA(crRNA),和另一把剪刀结合。如果同样的病毒再次进攻,它们就可以迅速匹配到敌人,然后Cas会特异性地切断对方的DNA,从而保护细菌免受病毒侵袭。
问:CRISPR技术从被发明到获得诺贝尔奖仅仅用了8年,它到底具有哪些重大价值?
答:在回答这个问题之前,我们必须了解一下基因编辑领域的现状。在CRISPR广泛应用之前,基因编辑主要依赖于基因突变技术、转基因技术、RNA干扰(RNAi)技术、核外遗传技术、同源重组技术等几个技术进行,这些技术在精准性、高效性和适应性等方面都存在一定问题。比如基因突变技术最大的问题在于突变的随机性,无法控制突变位点,因此有益突变频率仍然较低,变异的方向和性质难以控制。RNAi技术是相对高效并且相对特异的,但仍存在对靶基因的抑制不彻底等问题。
反观CRISPR基因编辑技术,其精髓在于精准基因组编辑。此外,由于PAM序列结构简单(5’-NGG-3’),几乎可以在所有的基因中找到大量靶点,因此得到广泛应用。Cas9和Cas12a能够在多种细胞种类和生物中起作用,其中,CRISPR/Cas9系统已经成功应用于植物、细菌、酵母、鱼类及哺乳动物细胞,是目前最高效的基因组编辑系统。
可以说,CRISPR/Cas技术提供了一种修改、调控和观察基因组的便捷且具备很强适应性的工具。这让它可以在许多领域的生物研究中得到应用。CRISPR/Cas工具极大地加快了科学研究的脚步,而基于Cas生物技术的研发同样进展迅速。多项基于Cas9的临床试验正在或即将进行。这些临床试验的结果将指引未来体细胞基因编辑在体外和患者中应用。CRISPR/Cas9在农业方面的应用已经产生了可以进入市场的产品。CRISPR/Cas工具箱日渐扩展的应用确立了这一系统在基因组编辑,甚至是基因工程领域的前沿位置。
问:虽然今年的诺贝尔化学奖颁给了埃曼纽尔·卡彭蒂耶和詹妮弗·杜德纳,但张锋也被认为在CRISPR/Cas9领域做出了重要贡献。从专利布局上看,两者有何差别,各自的技术贡献体现在哪些方面?
答:卡彭蒂耶、杜德纳和张锋三人是当之无愧的CRISPR三巨头:2012年8月17日,卡彭蒂耶、杜德纳合作,在科学杂志发表了基因编辑史上的里程碑论文,成功解析了CRISPR/Cas9基因编辑的工作原理。几个月后的2013年2月15日,张锋在科学杂志也发表了论文,首次将CRISPR/Cas9基因编辑技术应用于哺乳动物和人类细胞。此后,卡彭蒂耶和杜德纳获得了2015年的科学突破奖、2016年的阿尔珀特奖、2020年的沃尔夫奖和2020年的诺贝尔奖。而卡彭蒂耶、杜德纳和张锋三人则共同获得了2016年唐奖(Tang Prize)和2016年盖尔德纳国际奖。一开始,三人合伙创建基因编辑公司——Editas Medicine,但因谈判破裂,杜德纳单飞创立了Intellia Therapeutics公司。CRISPR/Cas9的专利之争就此开始。
卡彭蒂耶和杜德纳团队的专利申请日(2013年3月15日)早于张锋团队的专利申请日(2013年7月21日,要求了2012年12月12日的最早优先权),按理说,其占有的优势非常大。但是由于张锋团队启用了专利审查的快速通道,加速了审查流程。张锋团队被首先授予了一些重要专利,主要涉及将CRISPR系统用于真核细胞(包括人类细胞)。由于CRISPR基因编辑在疾病治疗和基因改造方面极具应用价值,在真核细胞中的专利显然是含金量最高的。
卡彭蒂耶和杜德纳的专利主要涉及CRISPR的系统,包括CRISPR系统中所必须的各组分的设计,如DNA-靶RNA、用于位点特异性修饰的靶DNA、位点特异性修饰的多肽、靶DNA的位点特异性修饰的方法、靶核酸、试剂盒和组合物、遗传修饰的细胞和由此转基因的非人多细胞有机体等。
张锋在中国的专利申请始于2013年(WO2014018423A2,发明名称为“可诱导的DNA结合蛋白和其基因组的干扰工具和应用”,申请日为2013年7月21日,最早优先权为2012年7月25日),他在中国的主要专利申请有40多件,主要涉及CRISPR系统的应用,例如基于CRISPR效应系统的诊断;用于基因组编辑以及用于特定靶向和治疗的CRISPR/Cas系统和组合物的递送、用途和治疗应用;对CRISPR复合物的组分进行编码的载体和载体系统以及用于设计和使用这种载体的方法;新型CRISPR酶以及系统等。
问:在CRISPR被证明具有基因编辑功能后,该项技术很快就被用于遗传疾病的治疗。国内关于CRISPR/Cas9技术的专利申请是否也呈现增长趋势,主要申请人有哪些?
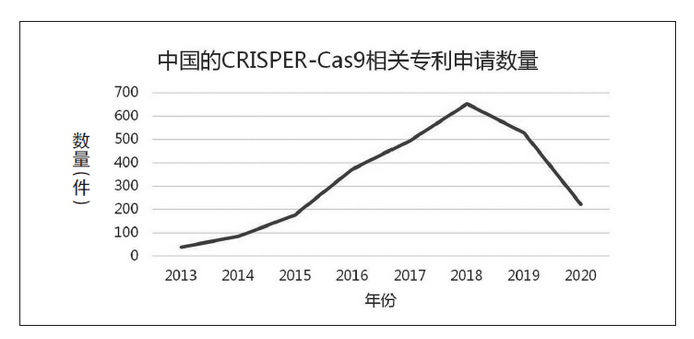
答:如图表可见,除了2019年略有下降、2020年尚未结束以及疫情影响外,近年来随着CRISPR/Cas9技术的广泛应用,国内关于该技术的专利申请的确是呈现逐年增长的趋势。
在中国的主要专利申请人包括中国农业大学、中国科学院遗传与发育生物学研究所、华南农业大学、中国农业科学院作物科学研究所、浙江大学、中国科学院上海生命科学研究院、华中农业大学等科研院校。
问:目前,国内CRISPR/Cas9技术主要应用在哪些领域?
答:国内CRISPR/Cas9技术的主要应用领域涉及:
对CRISPR/Cas9系统本身进行改造,从而提高基因编辑的特异性、效率以及安全性。例如中国人民解放军第二军医大学的专利申请CN104805099A提供了一种更安全的编码Cas9蛋白的核酸分子。实验发现目前广泛应用的Cas9表达载体虽然能成功表达Cas9蛋白发挥作用,但载体所转录的mRNA序列本身可以作为microRNA let-7家族的吸附体而抑制let-7的功能,而let-7可以抑制多个癌基因的表达,因此目前应用的Cas9表达载体可以增加一些癌基因的表达从而增加癌症的风险。该专利申请提供的M-mir-Cas9表达载体所转录出的mRNA不能吸附let-7,同时依然能翻译成完整的Cas9蛋白发挥作用,增加CRISPR/Cas9基因编辑工具的安全性。
动植物基因的定点修饰、敲除等,以构建动植物突变体库,用于动植物的育种工作。例如青岛市畜牧兽医研究所的专利申请CN103805605A提供了一种通过Cas9系统在细胞或个体水平上对绵羊DKK2基因进行敲除或修饰,以解析绵羊DKK2基因的功能、构建绵羊DKK2基因突变库,为绵羊育种服务。安徽省农业科学院水稻研究所的一系列相关专利申请构建了植物CRISPR/Cas9打靶重组载体,通过剪切造成水稻细胞DEP2基因、Ehd3基因、OsCHI基因等出现功能缺失突变,通过对功能缺失突变的株系进行表型鉴定,快速获得闭颖授粉水稻、褐壳水稻以及生育期延长的水稻材料。
动植物基因的特异性敲除,用于治疗疾病。例如上海金卫生物技术有限公司的一系列专利申请,使用CRISPR/Cas9特异性敲除人PD1或人CCR5基因,从而精确靶向人PD1基因或人CCR5基因并且实现基因敲除;武汉大学的专利CN104480144B涉及一种可用于艾滋病基因治疗的CRISPR/Cas9重组慢病毒载体及其慢病毒,能够在艾滋病毒辅助受体CXCR4的4个不同位点突变基因序列,且突变率高75%。经过重组慢病毒载体改造后的细胞不能被HIV感染。该方法较RNAi Knockdown、ZFN和TALEN等基因编辑技术具有更高的抑制艾滋病毒复制的效率,该系统构建快速、简单、价廉且能阻止HIV病毒入侵,适合用于艾滋病基因治疗。
病毒DNA的特异性敲除,用于治疗疾病。例如南京大学的专利申请CN103911376A涉及CRISPR/Cas9特异性敲除乙型肝炎病毒cccDNA。利用该发明制备的特异性靶向乙型肝炎病毒cccDNA的sgRNA能够精确靶向乙型肝炎病毒cccDNA并且实现基因敲除。
构建动植物以及细胞模型的药物筛选。例如上海云舜生物技术有限公司的专利申请CN104293831A基于CRISPR/Cas9基因编辑技术建立高血压小鼠模型,与现有技术相比,该发明技术方案是一种便捷、耗时短、效果好的方法;中国人民解放军第二军医大学的专利申请CN104726494B利用CRISPR/Cas9技术诱导干细胞中特异位点染色体易位发生,由此制备了细胞模型,以及进一步构建携带特异位点染色体易位的动物模型的方法。这对于研究染色体易位,融合基因的功能,染色体相互作用的研究,以及药物的筛选评价,都有较大应用前景;中国农业大学的专利申请CN105463027A利用CRISPR/Cas9修饰猪Trim63基因,获得高肌肉量及肥厚型心肌病模型克隆猪,无需再对克隆猪进行手术等人工干预手段,提高了构建疾病模型的效率。该发明还首次在大动物上利用成对Cas9n打靶载体对大动物进行基因编辑,为大动物利用CRISPR/Cas9技术进行基因功能研究及疾病模型建立奠定了基础。
- 专利类知识产权恶意诉讼的类型化判断
- 《2023年中国专利调查报告》:企业发明专利产业化率首次超50%
- 从后审程序看权利要求清楚的审查
- 专利产业化促进中小企业成长计划实施方案
- 五部门发《专利产业化促进中小企业成长计划实施方案》


