对瑞德西韦适用强制许可的法律路径
作为2020年最大的黑天鹅事件,新型冠状病毒疫情持续在全球蔓延和发酵。
作为2020年最大的黑天鹅事件,新型冠状病毒疫情持续在全球蔓延和发酵,截至2020年2月26日,全球已经确诊81127例感染患者,累计死亡2764例,人们都在期盼抗新冠病毒的特效药能够快点到来。2020年1月31日美国在《新英格兰医学杂志》详细报道了用瑞德西韦成功治愈一名新冠肺炎患者的案例[1]。2020年2月4日中国科学院武汉病毒研究所和北京药理毒理研究生在Cell Research期刊上发表了论文称在美国食品药物管理局(FDA)批准的药物中,瑞德西韦(remdesivir,GS-5734)和法匹拉韦(favipiravir,T-705)对2019-nCov临床分离株的体外抗病毒效果。2月5日,中日友好医院王辰、曹彬团队在武汉市金银潭医院宣布启动瑞德西韦治疗2019新型冠状病毒感染患者研究,瑞德西韦也被称为最有潜力的抗击新冠肺炎药物。
2月14日,法国媒体报道,法国波尔多医院附属医院宣布成功用瑞德西韦治愈一名48岁的华裔男子,主治医师称对该患者的治疗方法是“用一种直接作用于病毒以阻止其繁殖的抗病毒药,它是一种小分子,可以完美地扩散到肺部疾病的目标器官中,该产品称为瑞德西韦”[2]。
2月21日,科技部副部长徐南平表示,瑞德西韦正在武汉10家医院进行比较大规模的临床试验,已入组200多例重症和危重症患者,30多例轻型患者。世界卫生组织称,瑞德西韦等两项新冠药物的临床试验的初步结果有望在三周揭晓。与此同时,国内已有多家药企正在仿制瑞德西韦,包括博瑞医药、科伦药业、科本药业、海南海药等[3]。
一个现实的问题是,如果临床试验结果表明瑞德西韦是有效的,那么国家可以出于抗击疫情的需要依法对具有知识产权壁垒的瑞德西韦等药物授予强制许可吗?
国际协议下的强制许可制度
作为WTO一揽子协议中唯一全面覆盖知识产权的《与贸易有关的知识产权协定》(TRIPS协定),它要求WTO成员保护所有技术领域的发明(包括产品和方法),并且对专利权的获得和保护不得因发明所在地、所属技术领域及产品是本地生产或还是进口等因素作出歧视性规定[4]。
医药领域里的药品及药品生产方法当然也属于专利保护的客体。TRIPS协议第31条同时也对专利权的行使进行限制,即“未经专利权人授权的使用”制度。这里的“未经专利权人授权的使用”指的是政府使用或政府授权的第三方使用。按照是否需要使用人以合理的努力来寻求从专利权人处获得授权为前置条件,可以把“未经专利权人授权的使用”分为两种:
1、成员国处于国家紧急状态或其他极端紧急事件,或公共非商业性使用;
2、基于其他原因政府需要在未经专利权人授权下使用专利的。
一般的“未经专利权人授权的使用”均要求使用者已经按合理商业条款和条件努力从权利持有人处获得授权,且此类努力在合理时间内未获得成功,但在全国处于紧急状态或在其他极端紧急的情况下,或在公共非商业性使用的情况下,此要求可以豁免。另外,TRIPS协议还规定了“未经专利权人授权的使用”的“适当补偿原则”、“目的限定原则”、“非独占使用原则”、“不可转让原则”等等[5]。在笔者看来,TRIPS协议规定的“未经专利权人授权的使用”即是强制许可,且TRIPS协议已构建了强制许可制度的框架。
但是,TRIPS协议并未关切发生公共卫生事件时,一些发展中国家因对药品专利的保护而导致药品价格过高的问题。直到2001年11月,在发展中国家的努力下,围绕药品专利的保护和公共卫生健康,达成了《关于知识产权协议与公众健康问题的宣言》(多哈宣言)。多哈宣言规定,在遵守TRIPS协议约定的承诺基础之上,成员国可以规定一些灵活性的措施以应对公共卫生问题对许多发展中国家和最欠发达国家造成的影响。
这些灵活性的措施包括[6]:成员国有权授予强制许可且可以自由决定授予所述强制许可的理由、成员国有权决定何种情形下构成国家紧急状态或其他极端紧急事件等,其中诸如因艾滋病、结核病、疟疾及其他流行病等引起的公共健康危机,可以代表一种国家紧急状态或极端紧急事件。多哈宣言给予了成员国充分的自由授予强制许可,并且明确了出现传染病等突发公共卫生事件时,可以授予专利强制许以保护公共健康。但是,多哈宣言本质上是在TRIPS协议框架下达成的,因此,TRIPS协议中有关强制许可的规定,成员国仍然需要遵守,比如TRIPS协议中与强制许可(“未经专利权人授权的使用”)有关的“适当补偿原则”、“目的限定原则”等同样也适用于多哈宣言。
无论基于何种理由,强制许可制度一旦启动,为了充分利用被强制许可的药品专利,就得要求国家的医药行业有足够的生产能力来满足国内的需求。对于本国的制药企业没有制造能力或制造能力不足的,即便授予强制许可,也可能会遇到困难。为此,需要一套国际协作制度以解决强制许可制度下发展中国家和最欠发达国家制药能力不足的问题。在此背景下,2003年8月30日,WTO成员达成了《关于TRIPS协议和公共健康多哈宣言第六段的执行决议》(多哈执行决议)。多哈执行决议详细规定了执行药品专利强制许可的程序和条件,具体如下[7]:
1、事先向TRIPS理事会发出通知,通知内容包括:(i) 指定所需药品名称和期望的数量;(ii)已根据本《决议》附件中规定的方式之一证实其在所需药品的生产领域生产能力不足或没有生产能力;(iii) 确认医药产品在其地域取得专利权的成员方根据TRIPS协议第31条和本《决议》条款的规定已授予或打算授予强制许可;
2、强制许可应包含以下条件:(i)在强制许可制度下生产的(药品)数量只能是满足“符合条件的进口国”所必需的数量,而且全部产品必须出口到已向TRIPS理事会通知有该需求的成员国; (ii)在强制许可制度下生产的药品必须通过特别的标签或标记标识为是依据本《协议》确立的制度所生产,供应商必须使用特殊包装、特殊色彩或形状来区分此类产品,而且这些区分方式应可行且对价格没有显著影响的;(iii)被许可人必须在网站上公布。
3、出口成员国应向TRIPS理事会通报授予许可以及许可附加条件的有关情况。提供的信息应包括被许可人的人名(称)和地址,被授予许可的产品(名称),许可数量以及许可期间。
对于非最欠发达国家来说,在执行药品专利强制许可的程序时,最难同时也是最费时的步骤是对申请国在所需药品的生产领域生产能力的鉴定,多哈执行决议规定了严苛的鉴定标准。该鉴定标准是[8]:(i) 有关成员国已确认其在制药领域没有生产能力;或者(ii)该成员国在本领域有些生产能力,但对此能力进行审查以后发现,如果排除专利权人所拥有和控制的能力,其能力不足以满足自身需求。
多哈执行决议对发展中国家来说相当不友好,繁琐的程序和诡谲的鉴定系统很难充分发挥强制许可制度的作用。不过,多哈执行决议制定的初衷是为了解决在执行强制许可制度时,成员国没有足够成产能力的问题,因此对于一些有较强药品专利生产能力的发展中国家而言,可以不用走多哈执行协议规定的程序。
综上,我国加入的相关知识产权国际协议,已对强制许可作出具体的规定,搭建好了强制许可制度的框架体系。具体而言,对于国家出现紧急状态或其他极端紧急事件等非常情况,申请人不用先行就许可事宜与专利权人进行谈判即可向国家申请授予强制许可,对于其他强制许可的事由,申请人必须已经按合理商业条款和条件努力从权利持有人处获得授权,且此类努力在合理时间内未获得成功,才能向国家申请授予强制许可。
另外,启动强制许可制度时,发展中国家要考虑本国是否具备足够的专利药品生产能力,如果本国不具备足够的专利药品生产能力,需要让专利权人转移制药领域技术和生产能力的,则需要按照多哈执行决议规定的程序,向TRIPS理事会提出申请并按照规定对本国所需药品的领域生产能力进行鉴定;如果本国具备足够的专利药品生产能力,则可以走国内仿制药程序即可,不需要启动多哈执行决议规定的程序。
我国的强制许可制度
根据《专利法》的规定,有四种事由可以启动强制许可:
①专利权人自专利权被授予之日起满三年,且自提出专利申请之日起满四年,无正当理由未实施或者未充分实施其专利的;
②专利权人行使专利权的行为被依法认定为垄断行为,为消除或者减少该行为对竞争产生的不利影响的;
③在国家出现紧急状态或者非常情况时,或者为了公共利益的目的,国务院专利行政部门可以给予实施发明专利或者实用新型专利的强制许可;
④一项取得专利权的发明或者实用新型比前已经取得专利权的发明或者实用新型具有显著经济意义的重大技术进步,其实施又有赖于前一发明或者实用新型的实施的。
本文重点关注后两种事由。第③种事由为紧急状态下或为公共利益之目的的强制许可,对于这两种情形,可以不经任何人提出强制许可的申请,而由国家知识产权局直接作出强制许可的决定。国家出现紧急状态或者非常情况指的是,例如爆发战争、爆发大规模疫病、发生严重自然灾害等情况[9]。
另外,根据多哈宣言的规定,此处的紧急状态或非常情况也包括诸如因艾滋病、结核病、疟疾及其他流行病等引起的公共健康危机。显然,此次新型冠状病毒引发的全国疫情属于流行病引起的公共健康危机,可以解释成一种紧急状态或非常情况。第③种事由中的“为公共利益的目的”指的是[10],例如为了公共利益对一项获得专利的污染防治技术方案给予强制实施许可,因公共利益给予的强制实施许可,只能用于非商业目的。鉴于此处对“公共利益”的立法解释只列举了环境保护,根据谦抑原则不宜将此次新型冠状病毒引起的公共健康危机解释成为公共利益之目的。
第④种事由称为“交叉许可”。所属交叉许可是指对技术互相依存的发明或实用新型专利给予强制许可,在实际生活中,有时前一项发明或者实用新型专利与后一项发明或者实用新型专利是相互依存的,后一项专利如果不利用前一项专利中的某些专利技术就无法实施。在此情况下,如果两个专利权人互相之间不能在合理的条件下订立专利实施许可合同,则其中的专利技术就不能有效实施。
显然,这既不利于专利权人,也不利于科学技术的发展。但是,这并不意味着只要两个专利技术之间存在依存关系就一定会给予强制许可,强制许可作为一项严重限制专利权行使的制度,对其适用一定得有较为严格的限制条件。并且,通常取得专利权的发明或实用新型多少都会比原来的发明或实用新型在技术上有所进步,否则就不符合授予专利权的发明或者实用新型必须具备“三性”中的新颖性或者创造性条件。
若只要后一专利在技术上进步,就可给予其实施前一专利的强制许可,不利于保护前一发明或者实用新型专利权的利益,更有甚者,会出现只要对前一发明或者实用新型作出技术改进即可给予强制许可,这实际上等于架空了整个专利制度,对专利权人的保护也等同虚设。因此,《专利法》规定,专利权人若要申请前一专利的强制许可,则后一专利必须具有显著经济意义的重大技术进步。即,后一专利的经济价值和技术价值比前一专利都要高很多。
对于交叉许可,除了要求后一专利(从属专利)与前一专利(主专利)具有显著经济意义的重大技术进步之外,申请人在提出强制许可申请之前,应当以合理条件与前一专利权人签订实施许可合同,即申请人不能直接向国家知识产权局申请前一专利的强制许可,必须先按照平等互利、诚实信用的原则,与前一专利权人就实施许可事宜进行谈判。如果能够与专利权人在平等互利、诚实信用等原则下经过充分协商达成专利实施许可合同,不依赖于强制许可,在实施专利的过程中,通常更容易得到专利权人的积极配合,掌握有关实施专利的技术诀窍,有利于保证专利实施的成功[11]。
根据《专利法》第五十七的规定,无论强制许可是基于何种法定的事由提起的,取得实施强制许可的单位或者个人应当付给专利权人合理的使用费。其背后的法理是[12]:专利实施强制许可,目的是为了防止专利权人对其专利技术的不适当垄断,并没有使专利权人失去其专利所有权,这不是专利权的“征用”;因此,在专利实施强制许可的情况下,专利权人仍然享有请求实施其专利的人包括取得强制许可而实施其专利的单位或者个人支付专利使用费的权利。至于许可使用费多少算合理,先由双方进行协商,如果双方协商不成,由国家知识产权局部门裁决。
瑞德西韦的专利布局
吉里德科学公司(Gilead
Sciences)(以下简称Gilead)最早于2009年4月申请了用于抗病毒治疗的CARBA核苷类似物的化合物专利,并于2010年10月通过PCT程序进入中国,PCT申请号为US2009/041447,该CARBA核苷类似物的化合物专利在全球一共有一百多件同族专利。目前,其在中国的两个同族专利(CN104262345、CN102015714)均处于有效状态。该化合物专利公开了其分子式:
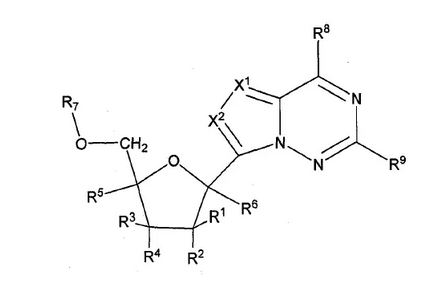
虽然瑞德西韦可以由上述分子式定义,但Gilead并未在上述化合物同族专利中公开瑞德西韦的分子式。
2011年7月22日,Gilead又对上述核苷类似物的化合物专利申请了用途专利(用于治疗副黏病毒科病毒感染)和化合物专利。也正是这次专利布局,首次公开了瑞德西韦的分子式:
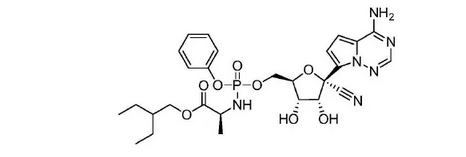
Gilead在全球一共布局了57件上述用途专利和化合物专利[13],其在中国也布局了两件专利,目前在中国的两件专利均处于有效状态(CN103052631B、CN105343098B),该同族专利的部分图谱信息如下:
以CN103052631B为例,Gilead此次不仅保护了瑞德西韦的用途专利(用于治疗副黏病毒科病毒感染),还保护了瑞德西韦的化合物专利。笔者认为,虽然Gilead在此次专利布局中保护了瑞德西韦的用途专利,但该用途仅限于治疗副黏病毒科病毒感染,并非用于治疗冠状病毒病毒感染,因此该用途专利不会成为掣肘。但是,由于Gilead在此次布局中单独保护了瑞德西韦的化合物专利,该化合物专利作为一项基础专利,是无论如何都绕不开的屏障。
2015年,Gilead对瑞德西韦进行了第三次专利布局,申请保护了瑞德西韦对埃博拉病毒的用途专利,其在中国也布局了两件专利,目前在中国的两件专利均处于审查状态中(CN107074902A、CNCN107073005A)该同族专利的部分图谱信息如下:
由于埃博拉病毒属于丝状病毒科,并不属于冠状病毒科,所以笔者认为此次专利布局不会对我国治疗此次新型冠状病毒引发的肺炎构成阻碍。
2016年9月,Gilead对瑞德西韦进行了第四次专利布局,申请保护了瑞德西韦对冠状病毒的用途专利,其在全球一共布局了12件用于治疗冠状病毒的用途专利,该12件同族的图谱如下:
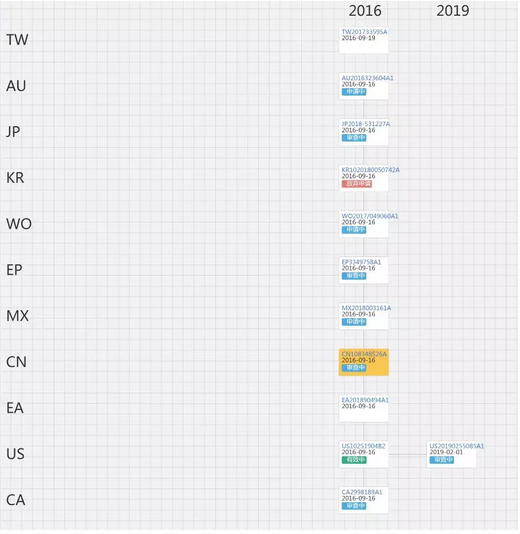
由以上图谱可以看出,Gilead在中国布局了一件冠状病毒用途专利(CN108348526A),并且其在全球布局的12件同族用途专利中,只在美国获得授权(授权专利号US10251904B2),其余基本都处于审查状态中。笔者经检索发现,最早公布瑞德西韦可能对冠状病毒有抑制作用的文献为2016年3月发表在Nature上的论文《therapeutic efficacy of the small molecule GS-5734 against Ebolavirus in rhesus monkeys》,文章称“瑞德西韦表现出针对沙粒病毒科、冠状病毒科、丝状病毒科和副粘病毒科病毒的抗病毒特性”。
然而,Gilead这次布局的专利的优先权日为2015年9月16日,远早于首次公开瑞德西韦对冠状病毒有抑制作用的日期,应当说此次冠状病毒用途专利的新创性较高,尽管目前在我国还处于申请阶段,但笔者认为授权的可能性较高。一旦Gilead在中国布局的冠状病毒用途专利获得授权,那么武汉病毒研究所申请的新型冠状病毒用途专利[14]的授权前景不容乐观。
这是因为,一方面,Gilead已将瑞德西韦治疗冠状病毒的用途申请专利,虽然新型冠状病毒作为新出现的病毒,并未明确写入,但已经包含在冠状病毒的概念中;另一方面,Gilead在冠状病毒用途专利中已经提到2003年在中国爆发的SARS病毒属于冠状病毒[15],而根据终南山院士的解释“新型冠状病毒是冠状病毒的一种,它跟SARS冠状病毒是平行的,二者是同一类(病毒)”[16],因此Gilead布局的冠状病毒用途专利会破坏武汉病毒研究所所申请的专利的创造性。
从2018年4月起,Gilead开始只针对瑞德西韦作进一步的布局,分别申请了瑞德西韦的结晶体专利和组合物专利,组合物专利尚未在中国进行布局,但结晶体专利在中国有布局,专利申请号为ZL201880028988.9。Gilead一共在全球布局了7件瑞德西韦结晶体的同族专利,该同族专利的图谱如下:
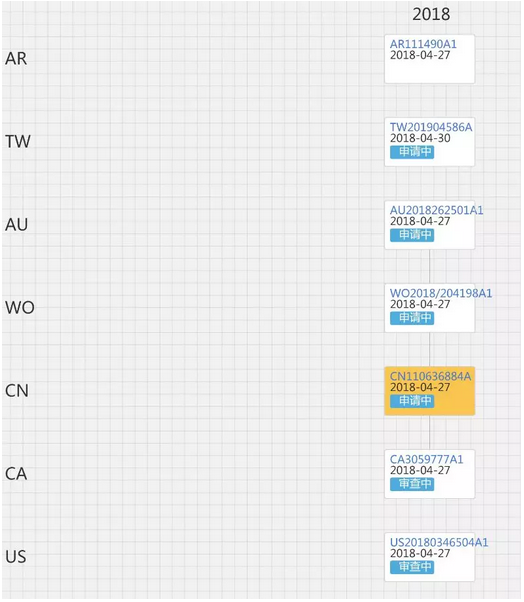
目前中国的同族专利尚处于申请阶段,且尚未进入实质审查阶段。笔者认为,鉴于中国的同族专利的申请公布日为2019年12月31日,距今也仅有2个多月,并且目前还未进入实审,其离最终授权尚有一段时间,较大概率是该专利授权后,疫情已经结束,因此,该专利对目前我国使用瑞德西韦治疗新冠肺炎的掣肘风险可控。
综上,Gilead在中国申请的两件瑞德西韦的化合物专利(CN103052631B、CN105343098B)均处于有效状态,这构成了我国药企仿制瑞德西韦的现实知识产权壁垒。Gilead在中国申请的瑞德西韦的冠状病毒用途专利(CN108348526A)授权前景较为明朗,并且该专利可能会破坏武汉病毒研究所申请的新冠状病毒用途专利的创造性。至于Gilead布局的瑞德西韦结晶体专利和化合物专利,它们当前不会掣肘我国药企仿制瑞德西韦。
对瑞德西韦专利的强制许可
一 、紧急状态下的强制许可
如上文所述,当国家出现紧急状态或非常情况时,国家可以直接授予专利的强制许可。另外,多哈宣言也给予了成员国充分的自由去决定何种情形构成紧急状态或极端紧急事件。爆发大规模疫病属于我国专利法规定的一种国家紧急状态或非常情况。根据多哈宣言,因艾滋病、结核病、疟疾及其他流行病等引起的公共健康危机,也可以作为一种国家紧急状态或极端紧急事件。因此,此次新型冠状病毒引发的全国疫情可以解释成一种紧急状态或非常情况。
一旦国家决定基于紧急状态授予强制许可,接下来要面对的问题是:我国是否有对瑞德西韦药品充足的生产能力?是否需要Gilead转移瑞德西韦药品生产技术和生产能力?如果我国企业自主完成了瑞德西韦原料药及制剂工艺研发,有能力仿制与原研药品质量和疗效一致的药品,并且其生产能力足够满足国内对瑞德西韦的需求的话,则这些企业可以不经与Gilead谈判,直接申请对瑞德西韦化合物专利的强制许可。
如果我国没有瑞德西韦药品充足的生产能力,且Gilead公司又不同意与中国企业谈判或没有与中国企业达成许可协议的话,此时只能按照多哈执行决议,向TRIPS理事会申请强制许可,强迫Gilead转移瑞德西韦药品的生产技术和生产能力。笔者留意到,最近许多国内药企公告称,其已经完成瑞德西韦原料药及制剂工艺研发,且具备年产百万支的规模化生产能力[17],因此大概率我国不会走多哈执行决议的强制许可程序。总体上,我国启动紧急状态下的强制许可不会有程序和实质上的阻碍。
二、交叉许可下的强制许可
如上文所述,启动交叉许可下的强制许可有两个前置条件:
①申请人在提出强制许可申请之前,应当以合理条件与前一专利权人签订实施许可合同,且在合理时间内未获得成功;
②从属专利须具有显著经济意义的重大技术进步。
目前,只有武汉病毒研究所申请的新型冠状病毒用途专利可以与Gilead在中国布局的瑞德西韦专利构成主从专利的关系。假设武汉病毒研究所获得新型冠状病毒用途专利的授权,并作为从属专利向国家知识产权局申请对瑞德西韦专利的强制许可,根据主专利的不同,情况也略有不同。
若以瑞德西韦的冠状病毒用途专利(CN108348526A)作为主专利:由于Gilead已经在该专利中公开瑞德西韦可以用于2003年在中国爆发的SARS冠状病毒,而新型冠状病毒与SARS冠状病毒是平行的,二者是同一类病毒,因此武汉病毒研究所的新型冠状病毒用途专利比瑞德西韦的冠状病毒用途专利的技术价值较低,很难说从属专利比主专利有重大的技术进步,因此不符合交叉许可的条件。
若以瑞德西韦的化合物专利(CN103052631B、CN105343098B)作为主专利:据公开资料显示[18],瑞德西韦是一种RNA聚合酶抑制剂,最早的研发初衷是抗埃博拉病毒( Ebola virus , EBOV) ,目前正在进行抗埃博拉病毒的III 期临床试验(NCT03719586);由于埃博拉病毒属于丝状病毒科,与新型冠状病毒所属的冠状病毒科不相同,应当说新型冠状病毒的用途专利和瑞德西韦的化合物专利相比还是有较大的技术进步,并且面对全球的疫情爆发,该用途专利的经济意义也十分显著,因此,武汉病毒研究所的新冠病毒用途专利满足了比主专利具有显著经济意义的重大技术进步的要件。
不过,无论以Gilead的哪个专利作为主专利,武汉病毒研究所在申请强制许可之前均应先与Gilead商谈专利授权许可事宜。Gilead也对瑞德西韦专利问题作出了回应:如果药物有效,我们要想办法提高产量,应用给更多的患者;专利问题,目前不是我们关注的中心,我们不会陷入专利的纠纷,我们努力找到一种帮助患者的方法。应该说,Gilead的态度还是愿意将其药物用于更多患者治疗,很大概率武汉病毒研究所会和其达成专利许可协议,因此笔者猜测交叉许可下的强制许可制度很难启动。
综上,出于快速战胜疫情、保证患者得到及时治疗之的目的,国家一方面要加紧扩大国内药企对瑞德西韦的生产能力以及时满足抗击疫情的需要,另一方面在时机成熟时依法以国家处于紧急状态或非常情况为由直接对瑞德西韦授予强制许可。
[1] Holshue, Michelle L., et al. "First case of 2019 novelcoronavirus in the United States." New England Journal ofMedicine (2020).
[2]https://www.20minutes.fr/sante/2718387-20200214-coronavirus-bordeaux-traite-antiviral-nomme-remdesivir-patient-plus-tout-porteur-virus.
[3] https://mp.weixin.qq.com/s/_X9n-neeKVZeWr9nGtaaWQ.
[4] Article 27 (Patentable Subject Matter), SECTION 5: PATENTS, TRIPS.
[5] Article 31 (Other Use Without Authorization of the Right Holder),SECTION 5: PATENTS, TRIPS.
[6]《TRIPS与公共健康多哈宣言》第5条。
[7] Article 2, Implementation of paragraph 6 of the Doha Declaration onthe TRIPS Agreement and public health.
[8]ANNEX, Assessment of Manufacturing Capacities in the PharmaceuticalSector, Implementation of paragraph 6 of the DohaDeclaration on the TRIPS Agreement and public health.
[9]《中华人民共和国专利法释义》对第四十九条的解释,全国人民代表大会常务委员会法制工作委员会编。
[10]《中华人民共和国专利法释义》对第五十条的解释,全国人民代表大会常务委员会法制工作委员会编。
[11]《中华人民共和国专利法释义》对第五十一条的解释,全国人民代表大会常务委员会法制工作委员会编。
[12]《中华人民共和国专利法释义》对第五十四条的解释,全国人民代表大会常务委员会法制工作委员会编。
[13]数据来自PatentCloud数据库。
[14]http://www.whiov.cas.cn/kyjz_105338/202002/t20200204_5497136.html.
[15] CN 108348526 A,说明书第【0008】段。
[16] https://baijiahao.baidu.com/s?id=1658150108833872485&wfr=spider&for=pc
[17] https://mp.weixin.qq.com/s/_X9n-neeKVZeWr9nGtaaWQ.
[18]《法匹拉韦、磷酸氯喹、瑞德西韦的前世今生》,Insight医药情报局。
-
上一篇:
-
下一篇:
- 哥伦比亚为抗艾滋病病毒药物申请强制许可
- 物联网背景下标准必要专利许可层级的选择
- 俄罗斯考虑引入版权强制许可制度
- 印尼公布专利强制许可法规来为新冠肺炎疫苗研发做准备
- 知识产权与公共利益——吉利德在疫情期间的知识产权开发和部署


